| chimica |
|
|||||
|
integrazione del metabolismo
La via del pentosio-fosfato
La glicogenolisi
Prima di dare uno sguardo alle integrazioni del metabolismo in generale occorre imparare due vie: quella del pentosio fosfato non solo perchè mette a disposizione della cellula il NADPH e il ribosio, ma anche perchè il ribosio 5-P è il precursore dell'istidina, un importante aminoacido La glicogenolisi occorre conoscerla perchè molti controlli ormonali agiscono su un enzima chiave di questa via, la glicogeno fosforilasi, che ha è un enzima particolarmente interessante.
sintesi di NADPH e di ribosio-5-fosfato
via del pentosio fosfato
Il NADPH è il trasportatore universale di energia sottoforma di potere riducente (elettroni) per le reazioni anaboliche. Oltre al NADPH la via del pentosio fosfato produce ribosio usato per la biosintesi degli acidi nucleici.
La via del pentosio fosfato inizia dal glucosio-6-fosfato e tramite quattro reazioni, di cui due ossidative che utilizzano deidrogenasi NADP+ dipendenti, ed una in cui si ha l'eliminazione di un atomo di carbonio sottoforma di CO2, si ottiene una molecola di ribosio 5P e 2 molecole di NADPH.
La glicogenolisi
nel muscolo
E' la via di demolizione del glicogeno alla fine del quale si
ottiene glucosio libero per rifornire, nel muscolo, la via glicolitica. 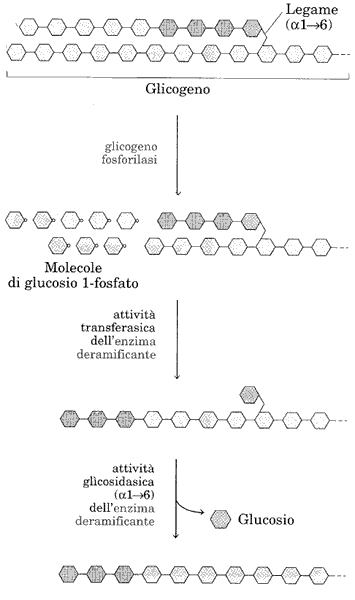 Nelle fibrocellule la fosforilasi, che quando il muscolo è
a riposo si trova prevalentemente nella forma inattiva chiamata fosforilasi
b, viene, durante uno sforzo intenso, attivata
dalla azione dell'ormone adrenalina che fosforilando un residuo di serina la trasforma nella
forma attiva, fosforilasi a.
Nelle fibrocellule la fosforilasi, che quando il muscolo è
a riposo si trova prevalentemente nella forma inattiva chiamata fosforilasi
b, viene, durante uno sforzo intenso, attivata
dalla azione dell'ormone adrenalina che fosforilando un residuo di serina la trasforma nella
forma attiva, fosforilasi a.
La fosforilasi a catalizza la rottura del legame α 4 glicosidici, cioè quelli lineari fino a quattro postazioni precedenti al punto di ramificazione.
E' interessante osservare come l'idrolisi del legame α avvenga per addizione di fosfato inorganico producendo molecole di glucosio 1P. A questo punto interviene l'enzima deramificante prima con l'attività transferasica e poi con quella 6 glicosidasica. [vedi ura]
La ura schematizza una piccola porzione di una molecola di glicogeno, con una ramificazione. la glicogeno fosforilasi stacca, partendo dall'estremità libera a sinistra, le prime cinque molecole di glucosio. Si ferma a quattro monomeri prima del punto di ramificazione. Interviene allora l'enzima deramificante che prima trasferisce tre molecole sul polimero lineare e poi stacca il glucosio del punto di ramificazione. L'ultima ura mostra un polimero completamente lineare sul quale può ricominciare l'azione della fosforilasi a.
nel fegato
la glicogeno fosforilasi è attivata dall'ormone glucagone Quando i livelli di glucosio ematici (glicemia) sono troppo bassi, il glucagone attiva un enzima (la fosforilasi b chinasi) che converte la fosforilasi b in fosforilasi a, rendendo disponibile glucosio da immettere nel sangue.L'insulina agisce in senso inverso, favorendo la defosforilazione degli enzimi che attivano la fosforilasi b.
L'ossidazione degli acidi grassi
Gli acidi grassi sono componenti essenziali dei fosfolipidi di membrana, sono una potenzialmente enorme riserva energetica e alcuni derivati degli acidi grassi fungono da ormoni e messaggeri intracellulari.
I trigliceridi, triacilgliceroli, sono le principali molecole portatrici di acidi grassi nella dieta dei vertebrati ed anche la forma di accumulo lipidico nei tessuti adiposi. Inoltre il fegato dei vertebrati riesce a convertire i carboidrati in eccesso in acidi grassi da esportare negli altri tessuti.
I triacilgliceroli sono la principale fonte di energia per il muscolo a riposo o in contrazione modesta, per il fegato e il cuore. Ricordiamo che un triacilglicerolo è formato da una molecola di glicerolo esterificato nei suoi tre ossidrili da tre acidi grassi
I trigliceridi ingeriti, costituiti da macroscopiche particelle insolubili in acqua, vengono convertiti in micelle finemente disperse, dall'azione dei sali biliari in modo d'aumentare notevolmente la superficie d'esposizione alle lipasi solubili in acqua. I prodotti dell'azione delle lipasi, acidi grassi, mono-di-trigliceridi e glicerolo passano nelle cellule parietali intestinali nelle quali avviene la riesterificazione degli acidi grassi e la successiva incorporazione in speciali proteine allo scopo di evitare la formazione di grossi aggregati insolubili in acqua. Si formano così complessi lipoproteici, i chilomicroni, in cui la componente lipidica è all'interno e quella proteica, idrofila, all'esterno. I chilomicroni vengono trasferiti dalla mucosa intestinale al sistema linfatico dal quale passano nel sangue che li trasporta al tessuto adiposo e a quello muscolare.
Gli acidi grassi si trovano in uno stato di riduzione più elevato dei glucidi per cui la loro completa ossidazione richiede un processo più energico e da essi si ricava una quantità di energia superiore a quella fornita dai glucidi.
L'utilizzazione degli acidi grassi dei trigliceridi, nel tessuto muscolare, avviene dopo idrolisi diretta da una lipasi regolata dall'attività di ormoni come l'adrenalina e il glucagone che l'attivano e come l'insulina che, al contrario, inibisce la lipasi.
Mentre il glicerolo venendo convertito in diidrossiacetone e quindi in gliceraldeide prende la via glicolitica, gli acidi grassi vengono degradati mediante rimozioni sequenziali di unità acetato. Questo processo, mitocondriale, prende il nome di ossidazione degli acidi grassi.
Il passaggio degli acidi grassi dal citosol al mitocondrio prevede operazioni preliminari come l'attivazione degli acidi grassi che avviene a livello della membrana mitocondriale esterna ad opera di una acil-CoA sintetasi secondo lo schema:
Acido grasso + CoA + ATP acil-CoA + AMP + PPi.
Il passaggio attraverso la membrana interna avviene dopo che l'acil-CoA si è legato reversibilmente alla carnitina, per l'azione di un trasportatore specifico. Una volte nella matrice mitocondriale l'acido grasso è pronto per l'ossidazione da parte di enzimi specifici.
La β-ossidazione
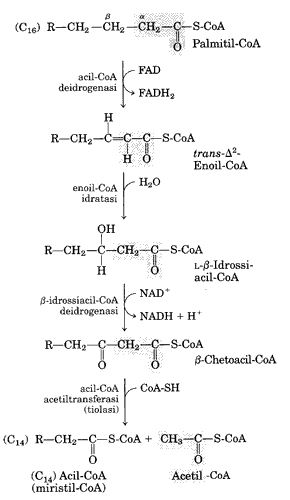
Lo schema a sinistra nella ina seguente, mostra i quattro passaggi in cui un acido grasso a 16 atomi di carbonio, l'acido palmitico, attivato col legame al CoA entra, tramite la carnitina, nella matrice mitocondriale ed è soggetto
all'azione sequenziale di quattro enzimi che ossidano l'atomo di C in che dal -CH2- iniziale lega, alla fine un gruppo acido esterificato dal gruppo tiolico del CoA. Ne risulta un acil-CoA con due atomi di carbonio in meno. L'atomo adiacente al gruppo carbossilico è l'atomo in al quale si lega l'atomo in Questo atomo sarà soggetto ai quattro passaggi alla fine del quali sarà ossidato fino al punto di rompersi in quella posizione e liberare un acetil-CoA e un acido grasso con due atomi di carbonio in meno.
I quattro passaggi della ossidazione:
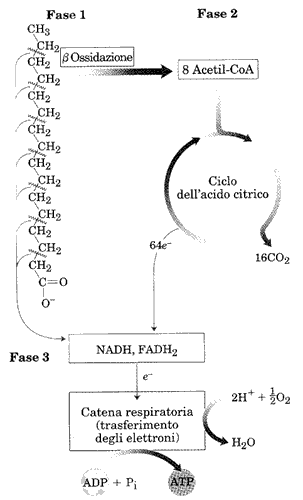
Le reazioni ricominciano nello stesso modo (schema a destra) fino a frantumare l'acido grasso in tanti gruppi acetato pari alla metà degli atomi di Carbonio della catena. Come si vede nella ura, (FASE 1) un acido grasso a 16 atomi di C libererà 8 acetil-CoA. Ciascuno entra nel ciclo di Krebs (FASE 2) per l'ossidazione completa a CO2. Gli elettroni sottratti entrano nella catena respiratoria (FASE 3) per il trasferimento definitivo all'ossigeno e la contemporanea fosforilazione dell'ADP.
Resa energetica dell'ossidazione degli acidi grassi a CO2 e H2O
Prendiamo come esempio un acido a 16 atomi di carbonio, come nei due schemi in questa ina. Procediamo in sequenza. L'acido grasso entra nei mitocondri e in questa sede comincia l'attacco all'atomo di carbonio in ß che dapprima viene deidrogenato dalla acil-CoA deidrogenasi. Si forma un doppio legame tra gli atomi in e quello in al quale verrà addizionata acqua ed in si addizione l'ossidrile. Una nuova deidrogenasi termina l'ossidazione e la tiolasi, addizionerà un CoA provocando la rottura e la liberazione del primo acetil-CoA che entrerà nel ciclo di Krebs. Resta un acido grasso con due atomi di carbonio in meno che ricomincia la spirale con un nuovo attacco della acil-CoA deidrogenasi. E così via fino alla produzione di 8 acetil-CoA che entreranno tutti nel ciclo di Krebs. In questi cinque passaggi si liberano un NADH ed un FADH2 per ogni giro della 'spirale'. In totale, da un acido grasso a 16 acidi di carbonio, si libereranno 7 NADH e 7 FADH2. (l'ultimo passaggio libera direttamente due acetati)
Considerando che otto acetati entrano nel ciclo di Krebs per la totale ossidazione a CO2 seguiamo il solito schema:
|
|
moli di ATP |
tappe della produzione |
|
7x2= 7x3= 24x3= 8x2= GTP TOTALE = |
|
dall'azione dell'acil-CoA deidrogenasi e la riossidazione dei FADH2 dall'azione della -idrossiacil-CoA deidrogenasi e la riossidazione dei NADH Dalla riossidazione dei 3x8 NADH nel ciclo di Krebs Dalla riossidazione degli 8 FADH2 nel ciclo di Krebs 8 moli di GTP formati a livello di substrato dalla succinil-CoA sintetasi nel ciclo di Krebs |
Poiché durante l'attivazione dell'acido grasso vengono consumate 2 moli di ATP, la resa netta è di 129 ATP. Considerando che l'ossidazione completa alla bomba calorimetrica fornisce, per un acido grasso a sedici atomi, un ∆G°' di circa 2344 Kcal/mole, calcolando avremo una liberazione di energia libera fisiologica pari a 129 x - 7.3 = 941 Kcal/mole. Anche in questo caso la resa, altissima, è di circa il 40%. del massimo teorico.
I corpi chetonici
Nel fegato dei mammiferi non tutto l'acetil-CoA derivato dall'ossidazione degli acidi grassi entra nel ciclo di Krebs ma, quando la degradazione lipidica è eccessiva, una certa parte di acetil-CoA viene convertito in ' corpi chetonici'. Il perché lo si capisce facilmente ricordando che l'acetato utilizzabile nel ciclo dell'acido citrico dipende dalla concentrazione di ossalacetato che a sua volta è legato al catabolismo dei glucidi. L'ossalacetato infatti si forma, con reazione anapletorica, dal piruvato. (vedi) E' interessante osservare come durante il digiuno l'ossalacetato viene sottratto e utilizzato in una via metabolica (che vedremo) per formare glucosio (gluconeogenesi): così l'acetil-CoA in eccesso viene trasformato in corpi chetonici, utili combustibili alternativi per molti tessuti 'nobili' come il cuore e i reni, ma anche, in caso di necessità, per il cervello. I corpi chetonici sono composti solubili sia nel sangue che nelle urine. A parte l'acetone, che viene eliminato con la respirazione, i due corpi chetonici più importanti sono l'acetoacetato e il idrossibutirrato, che, prodotti nei mitocondri epatici, da questi diffondono nel sangue e vanno ai tessuti che li ossidano.
IN DEFINITIVA:
Quando, come nel caso di digiuno, si determina un aumento della biosintesi di glucosio, nella cellula epatica si si ha la sintesi e l'esportazione dei corpi chetonici.
Le biosintesi riduttive
I processi biosintetici sono rappresentati dalle vie anaboliche endoergoniche che possono avvenire sfruttando l'ATP e il NADH (meglio NADPH) prodotti nelle vie cataboliche ossidative che abbiamo visto. Catabolismo ed anabolismo procedono contemporaneamente nelle cellule in modo che le vie degradative, producendo energia, consentano, in un equilibrio dinamico, di spingere le vie sintetiche che mantengono un alto grado di ordine intracellulare.
La gluconeogenesi
E' la via universale per la sintesi di glucosio da molecole non glucidiche. Il glucosio in eccesso sarà poi la base per la sintesi del glicogeno negli animali e dell'amido e del saccarosio nelle piante.
Considerando che il cervello dell'uomo consuma circa 120 g. di glucosio al giorno e rappresenta la principale fonte d'energia per i tessuti embrionali, per gli spermatozoi, per la midollare del surrene e per i globuli rossi, si capisce quanto sia importante, nei tessuti animali, la biosintesi di glucosio.
La gluconeogenesi avviene principalmente nel fegato dei mammiferi ed è citosolica, come la glicolisi, dalla quale differisce per tre deviazioni nelle reazioni irreversibili.
Se la glicolisi converte il glucosio in piruvato, la gluconeogenesi converte il piruvato in glucosio e le due vie sono ovviamente soggette ad una regolazione coordinata e reciproca. La ura mostra le tre deviazioni della gluconeogenesi che sono le tape catalizzate dalle chinasi. Ovviamente poiché la direzione è quella della glicolisi, la gluconeogenesi va seguita cominciando dal basso.
Nella prima deviazione, la conversione del piruvato in P.E.P. è parzialmente mitocondriale e parzialmente citosolica.
Il piruvato può provenire anche dalla alanina per transaminazione (GPT). Esso, nei mitocondri, viene carbossilato dalla piruvico carbossilasi in ossalacetato (enzima già visto come via anapletorica ). Tale enzima è il primo enzima regolatore della gluconeogenesi essendo attivato dall'acetil-CoA. Attraverso il malato viene riprodotto ossalacetato citosolico che subisce l'azione della PEP carbossichinasi,con il GTP donatore di fosfato. Si forma così fosfoenolpiruvato che prosegue la via glicolitica al contrario fino al fruttosio 1,6 difosfato che, prodotto nella glicolisi in una reazione irreversibile, dovrà essere defosforilato con una seconda deviazione che consiste nell'idrolisi del gruppo fosfato in C1 ad opera della fruttosio 1,6 difosfatasi. [il fosfato non viene trasferito, ma staccato per idrolisi]
La terza deviazione è al conversione del glucosio-6-P in glucosio libero con una nuova idrolisi operata dalla glucosio 6-fosfatasi.
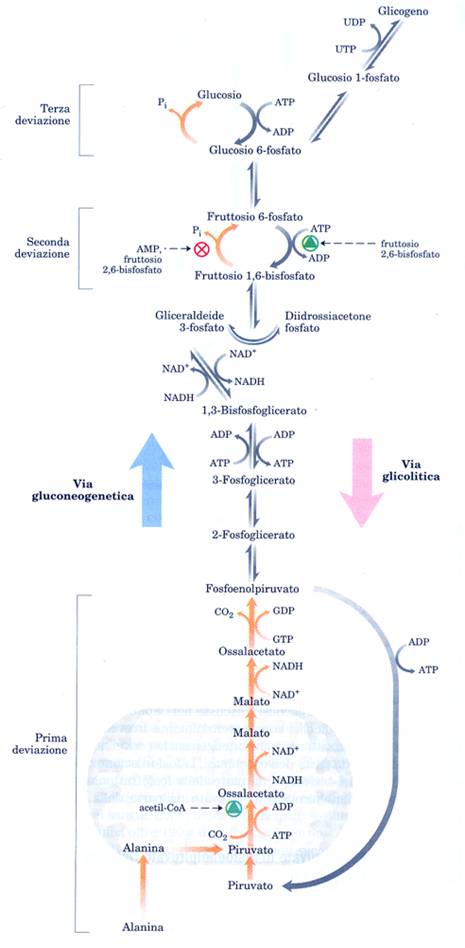
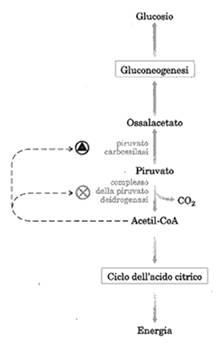
La glicolisi e la gluconeogenesi, come detto saranno controllate reciprocamente perchè ovviamente non si può demolire glucosio (glicolisi) se si ha bisogno di sintetizzarlo. Se l'acetil-CoA è abbondante esso bloccherà la glicolisi a livello della PFK e della PDH, e attiverà la conversione del piruvato in ossalacetato funzionando da effettore positivo sulla piruvato carbossilasi.
Biosintesi del glicogeno
Il glicogeno è un polimero del glucosio sintetizzato dalle cellule dei mammiferi e utilizzato come riserva energetica nel fegato e nei muscoli. Durante brevi digiuni, quando la concentrazione del glucosio nel sangue decresce, il glicogeno epatico viene degradato, tramite la glicogenolisi, fornendo glucosio libero da immettere nel sangue per ripristinare i normali livelli di glicemia (omeostasi glucidica). Il glicogeno muscolare, con la glicogenolisi, ha la funzione di mettere a disposizione delle fibrocellule muscolari, glucosio da ossidare per produrre energia.
Il glicogeno è un omopolisaccaride molto ramificato in cui le molecole di glucosio sono legate da legami 4 glicosidici nelle parti lineari e da legami 6 glicosidici nei punti di ramificazione.
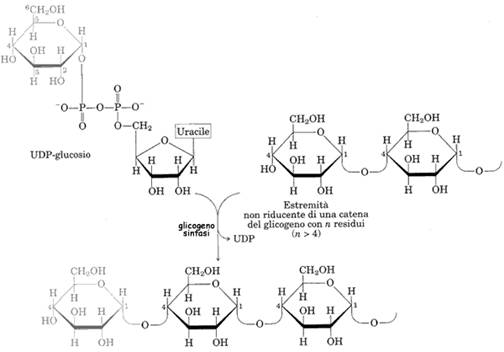 Il punto di partenza della sintesi di glicogeno è il
glucosio-6-P, rapidamente convertito in glucosio-l-P dall'enzima glucofosfomutasi.
La glicogenosintesi ha un fondamentale passaggio iniziale, quello dell'attivazione
del glucosio-l-P
Il punto di partenza della sintesi di glicogeno è il
glucosio-6-P, rapidamente convertito in glucosio-l-P dall'enzima glucofosfomutasi.
La glicogenosintesi ha un fondamentale passaggio iniziale, quello dell'attivazione
del glucosio-l-P
ad opera dell'UDP-glucosio pirofosfatasi. L'UDP è un nucleotide difosfato che funziona da donatore di glucosio nella reazione di sintesi eseguita dalla glicogeno sintasi. [il glucosio attivato dall'UDP e aggiunto alla catena è in grigio chiaro]
L'ossidazione degli aminoacidi
Il pool plasmatico di aminoacidi deriva, oltre che dalla dieta, dalla degradazione delle proteine intracellulari (proteine tissutali).
A differenza dei lipidi che possono essere conservati in quantità
notevoli nel tessuto adiposo e dei glucidi che, se in eccesso,
possono essere conservati solo nei pochi mg di glicogeno contenuti nel muscolo
e nel fegato oppure eliminati con le urine, gli aminoacidi che eccedono il
fabbisogno delle sintesi di proteine o di altre biomolecolecole non possono
essere né conservati né e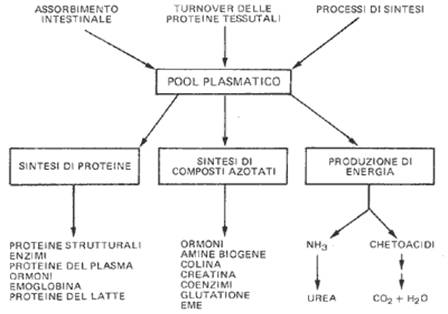 screti.
screti.
Il destino degli aminoacidi in eccesso è quindi quello di essere indirizzati verso il metabolismo energetico previa rimozione dei gruppi amminici. Lo scheletro carbonioso che rimane, un chetoacido, entra, in qualche modo, nei cicli ossidativi che abbiamo studiato. (ciclo di Krebs)
L'utilizzazione degli aminoacidi nel catabolismo avviene ovviamente anche se le necessità energetica non è soddisfatta da altri nutrienti ed in questo caso sono le proteine tissutali ad essere degradate per fornire aminoacidi. Lo schema mostra gli aspetti generali del metabolismo degli aminoacidi. E' interessante sapere che il catabolismo degli aminoacidi contribuisce al fabbisogno energetico per oltre il 15% del totale.
La prima tappa del catabolismo aminoacidico è dunque la
rimozione del gruppo α-amminico tramite enzimi altamente specializzati
chiamati aminotransferasi o, più comunemente, transaminasi. Le
transaminasi non operano una vera e propria perdita dei gruppi amminici, ma un trasferimento su un chetoacido, generando un
nuovo aminoacido.
amminici, ma un trasferimento su un chetoacido, generando un
nuovo aminoacido.
Nella maggior parte degli aminoacidi il gruppo amminico viene trasferito all'atomo di carbonio in α dell'a-chetoglutarato con formazione dell'a-chetoacido corrispondente all'aminoacido che trasferisce il gruppo amminico.
Come si vede nell'esempio di transaminazione in ura, il gruppo
amminico viene trasferito dall'alanina, un aminoacido, all'a-chetoglutarato,
un chetoacido che diviene così glutammato (acido
glutammico, un importante aminoacido). L'alanina, a sua volta, perdendo
il gruppo amminico, forma il chetoacido piruvato. Sia il piruvato
che l'a-chetoglutarato li abbiamo già incontrati nel metabolismo
energetico. Questa reazione è catalizzata da una transferasi, e
precisamente l'alanina aminotrasferasi, ALAT, chiamata anche glutammico piruvico transaminasi (GPT). il distacco del gruppo amminico avviene perché le
transaminasi contengono, come coenzima, il piridossalfosfato (PLP), derivato
dalla piridossina, la vitamina B6. Il meccanismo di catalisi delle
transaminasi si chiama meccanismo a ping-pong. L'aminoacido si lega all'enzima,
cede al PLP il gruppo amminico e si allontana come chetoacido. Il sito attivo
del PLP può così legare il chetoacido e cedere il gruppo amminico
rimosso precedentemente. Molti aminoacidi vengono transaminati cedendo il
gruppo amminico all'a-chetoglutarato. E' evidente quindi che il glutammato
che si forma è un aminoacido importante nel metabolismo dei gruppi
amminici (-NH2, NH3, NH4+) raccogliendoli,
per transaminazione sull'a-chetoglutarato, da molti aminoacidi. Il
glutammato, citosolico, entrerà nei mitocondri epatici d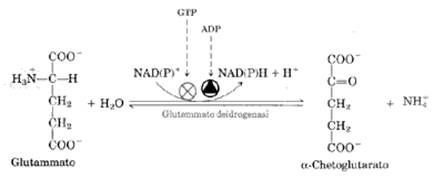 ove cederà il gruppo amminico sotto forma di ione ammonio
NH4+ che entrerà nel ciclo di produzione dell'urea
ed eliminato con le urine. La rimozione mitocondriale dei gruppi
amminici del glutammato è operata, tramite una deaminazione ossidativa, da un
enzima che si chiama glutammato deidrogenasi (GDH), come si vede nella ura. Come si vede la GDH
è un enzima allosterico, modulato positivamente dall'ADP ed inibito
dalla GTP.
ove cederà il gruppo amminico sotto forma di ione ammonio
NH4+ che entrerà nel ciclo di produzione dell'urea
ed eliminato con le urine. La rimozione mitocondriale dei gruppi
amminici del glutammato è operata, tramite una deaminazione ossidativa, da un
enzima che si chiama glutammato deidrogenasi (GDH), come si vede nella ura. Come si vede la GDH
è un enzima allosterico, modulato positivamente dall'ADP ed inibito
dalla GTP.
L'azione combinata delle transaminazione e della deaminazione ossidativa, convoglia, nel citosol, i gruppi amminici nel glutammato dal quale verranno in sede mitocondriale definitivamente rimossi.
Nei tessuti extraepatici, oltre alla transaminazione, sono attivi meccanismi ossidativi di rimozione che liberano un gruppo amminico netto che si converte in ammoniaca, NH3, molecola estremamente neurotossica alterando, probabilmente, il pH intracellulare.
L'organo deputato alla eliminazione dell'NH3 è
il fegato. Non potendo essere esportata nel sangue, per la sua
tossicità, l'ammoniaca viene, nei tessuti extraepatici, cervello
compreso, convertita in un composto non tossico, la glutammina.
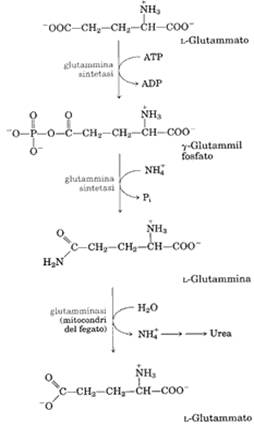
Come si vede in ura, la glutammina, si forma per addizione enzimatica, catalizzata dalla glutammina sintetasi, di un gruppo amminico al glutammato preventivamente esterificato con un gruppo fosfato su un gruppo acido.
Si ha così la trasformazione del glutammato, polare, in glutammina che, essendo neutra, può facilmente attraversare le membrane cellulari e, passata nel sangue, viene trasportata al fegato. Il suo azoto ammidico verrà rilasciato sotto forma di ammoniaca solo nei mitocondri epatici ad opera di un enzima chiamato glutamminasi, ed entrerà nel ciclo di produzione dell'urea, molecola solubile che sarà escreta con le urine. Si realizza così l'eliminazione dell'N amminico degli aminoacidi. Il loro scheletro carbonioso, un a-chetoacido, entrerà nel metabolismo energetico
L'alanina è un aminoacido chiave nel trasporto di gruppi amminici al fegato in forma non tossica. Nel muscolo si ha la transaminazione del glutammato sul piruvato. L'alanina passa nel sangue per raggiungere il fegato nel quale subirà una nuova transaminazione sull'a-chetoglutarato (reazione inversa della precedente) cedendo così il gruppo NH2 e riproducendo glutammato che lo convoglierà tramite la GDH, nel ciclo dell'urea. il piruvato può, tramite la gluconeogenesi produrre
glucosio da immettere in circolo ed esportare nel tessuto muscolare, che tramite la glicolisi, lo riconverte in piruvato. (ciclo del glucosio-alanina) L'ammoniaca liberata dalla deaminazione del glutammato (GDH) e dalla glutamminasi converge nel.
Ciclo dell'Urea
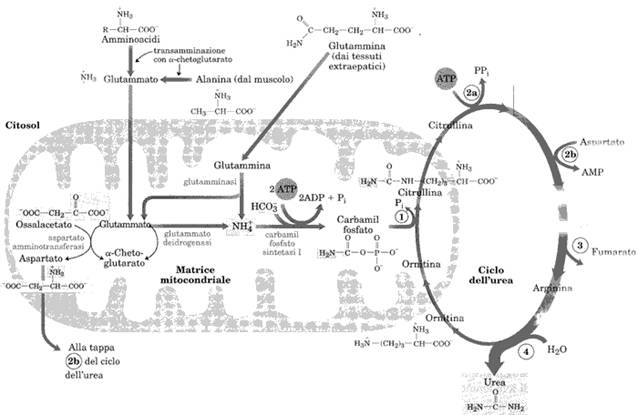
Come abbiamo visto i gruppi amminici di molti aminoacidi vengono, nel citosol epatico, trasferiti all'a-chetoglutarato formando glutammato che rappresenta quindi il centro di raccolta dei gruppi amminici. Nel muscolo l'aminoacido raccoglitore dei gruppi amminici è l' alanina, che passando nel sangue viene trasportata al fegato dove avviene la transaminazione sull'a-chetoglutarato catalizzata dalla GPT, glutammico piruvico transaminasi (oggi più nota come ALAT, alanina amminotrasferasi). [vedi ciclo glucosio alanina]. Nei tessuti extraepatici inoltre si ha, come detto, la sintesi di glutammina che raggiunge il fegato trasportando 'ammoniaca temporaneamente inattivata nella sua tossicità'.
Glutammato e glutammina vengono trasportati nei mitocondri epatici, nella matrice dei quali comincia il ciclo dell'urea, in parte mitocondriale ed in parte citosolico. In sintesi il ciclo dell'urea provoca l'addizione di due gruppi amminici allo ione bicarbonato HCO3- per produrre una molecola di urea (NH2)2-C=O ed è particolarmente dispendioso: circa il 15% dell'energia ricavata dall'ossidazione degli aminoacidi. Ma eliminare ammoniaca è troppo importante per badare a spese!
E' interessante osservare che il ciclo dell'urea entra in connessione col ciclo di Krebs a livello del fumarato che, prodotto nel citosol nel ciclo dell'urea, entra nei mitocondri per alimentare il ciclo di Krebs ed essere convertito in ossalacetato. A sua volta l'ossalacetato accetta un gruppo amminico dal glutammato con una transaminazione catalizzata dalla GOT, glutammato ossalacetato transaminasi (ASAT, aspartato aminotransferasi) e l'aspartato che ne deriva lascia il mitocondrio e dona il suo gruppo amminico al ciclo dell'urea.
|
Privacy
|
© ePerTutti.com : tutti i diritti riservati
:::::
Condizioni Generali - Invia - Contatta